Espectroscopia
Espectroscopia.
Newton, en 1666, observó que cuando un rayo de luz natural (luz blanca) pasa a través de un prisma óptico se descompone en otros colores más simples; es decir, el prisma dispersa o separa los colores simples o luces monocromáticas que componen la luz blanca o cualquier otra luz compleja o policromática.
El fenómeno de la dispersión de la luz se debe a que las distintas radiaciones que componen una luz compleja se propagan con distinta velocidad en los diversos medios transparentes y, en consecuencia, experimentan distinto ángulo de refracción. Como esta velocidad de propagación es directamente proporcional a la longitud de la onda de la radiación e inversamente proporcional al índice de refracción del medio, resulta que las radiaciones de menor longitud de onda son las más desviadas. Así entre las radiaciones que componen la luz blanca, las rojas (λ = 6.563 A). Y las violetas (λ = 3969 A) las que más se desvían de su trayectoria inicial.
Hasta la segunda mitad del siglo XX, la estructura de una sustancia era determinada usando información obtenida de reacciones químicas. Esta información incluía la identificación de grupos funcionales con ensayos químicos, junto con los resultados de experimentos de degradación en los cuales las sustancias se rompían en otras más pequeñas, o sea, en fragmentos más fácilmente identificables. Un ejemplo típico de este método es la demostración de la presencia de un doble enlace en un alqueno mediante la hidrogenación catalítica y su localización mediante ozonólisis.
Después de considerar todas las evidencias químicas disponibles, el químico proponía la estructura candidata ( o estructuras) que estaba de acuerdo con las observaciones. La prueba de la estructura se conseguía al convertir la sustancia en un compuesto ya conocido o mediante su síntesis.
Los ensayos cualitativos y las degradaciones químicas como pruebas estructurales han sido suplementadas y en gran medida sustituidas en la química orgánica actual por métodos instrumentales de determinación de la estructura. Las más destacadas de estas técnicas son la espectroscopía de resonancia magnética nuclear (rmn), espectroscopía de infrarrojos (ir), espectroscopía de ultravioleta-visible (uv-vis), y la espectroscopía de masas (EM). A pesar de ser distintas, todas ellas están basadas en la absorción de energía por una molécula y todas examinan cómo la molécula responde a esa absorción de energía.
Al describir estas técnicas haré énfasis en su aplicación a la tarea de la determinación de la estructura. El análisis sobre la naturaleza de la radiación electromagnética es un aspecto fundamental para entender las bases físicas de las que depende la espectroscopia molecular.
Tipos de Espectros:
Si un haz de rayos luminosos atraviesa primero una rendija y después un prisma óptico, experimentará una descomposición en tantos rayos distintos como colores tenga la luz compleja inicial. Recogiendo en una pantalla, o en una placa fotográfica todos los rayos de luz que salen del prisma, se obtendrán una serie de rayas o bandas diversamente coloreadas que no son otra cosa que las imágenes de la rendija inicial.
Estas imágenes reciben el nombre de rayas espectrales, y al conjunto de todas ellas se le denomina espectro. Según eso el espectro es el análisis de las distintas radiaciones o longitudes de onda emitidas por un foco luminoso. Los espectros pueden ser:
- De emisión: Si son originados por radiaciones emitidas por cuerpos incandescentes. Se dividen en:
- Continuos: Si poseen todos los colores de la luz blanca (rojo, anaranjado, amarillo, verde azul, índigo, y violeta.) En general los espectros continuos de emisión proceden de sólidos y líquidos incandescentes.
- Discontinuos: Si solamente contienen algunos colores de los siete que componen el espectro visible. Estos pueden ser:
- De bandas: Si la franja coloreada es suficientemente ancha. Proceden de gases y vapores en forma molecular.
- De rayas: Si la franja coloreada se reduce a una línea. Proceden de gases y vapores en forma atómica.
En realidad, los espectros de bandas están constituidos por una serie de rayas muy próximas entre sí, pudiendo resolverse la banda si la dispersión es grande.
- De absorción: Son los obtenidos por absorción parcial de las radiaciones emitidas por un foco luminoso cuando la luz producida por él atraviesa una sustancia en estado gaseoso, ya que todo gas o vapor absorbe, a cualquier temperatura, las mismas radiaciones que es capaz de emitir si estuviera incandescente.
El estudio experimental de los espectros condujo a una serie de consecuencias, prácticas y teóricas, que resumimos seguidamente:
- Cada elemento químico, convenientemente excitado, emite siempre unas radiaciones características de él y que sirven, por lo tanto, para identificarlo.
- La presencia de tales radiaciones es independiente de que el elemento esté solo, mezclado, o combinado con otros elementos; sus rayas espectrales son siempre las mismas y ningún otro elemento las puede emitir.
- La intensidad de las radiaciones emitidas y, por lo tanto, la de las rayas espectrales; es decir, su mayor o menor colorido en la placa, depende del número de átomos excitados, y éste, de la mayor o menor concentración del elemento.
El hecho de que cada elemento químico posea su propio espectro permite suponer que las longitudes de onda de las radiaciones emitidas por él, una vez excitado, estén relacionadas entre sí mediante alguna expresión matemática; lo que, en definitiva, vendría a demostrar que en el átomo solamente son posibles ciertos estados energéticos.
Durante mucho tiempo, la ciencia trató de encontrar fórmulas que relacionaran entre sí las frecuencias o las longitudes de onda, de estas radiaciones, sin llegar a ningún resultado positivo. Fue en 1885 cuando el físico suizo Balmer, al estudiar el espectro del hidrógeno observó que la longitud de onda, expresada en cm de las radiaciones correspondientes a las rayas estudiadas, venía dada por:
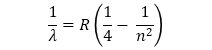
Donde:
n es un número entero que puede tomar valores 3,4,5,...
R es una constante, llamada constante de Rydberg, cuyo valor aproximadamente es 109740 cm-1.
Al conjunto de rayas comprendidas en la zona visible del espectro del hidrógeno se le dio el nombre de serie de Balmer.
El descubrimiento realizado por Balmer tuvo una importancia extraordinaria por que confirmaba con toda seguridad la existencia de determinados niveles energéticos dentro del átomo; de este modo, la emisión de una cierta radiación definida por una concreta longitud de onda correspondería a la producción de un fotón cuya energía fuese igual a la diferencia entre esos dos estados energéticos del átomo.
Luego de varios artículos, vuelvo y reitero, toda la información que llega a ustedes lectores por medio de este blog, es de mi autoria y/o una recopilación de distintas fuentes.

